#
Kelimpahan atau ketersediaan hidrogen di alam #
Hidrogen merupakan suatu unsur yang paling banyak di alam semesta yaitu sekitar 93% karena bintang-bintang mengandung hidrogen sebagai bahan bakar untuk menghasilkan cahaya.Jumlah hidrogen dibumi sekitar 3% atau 0,14 % massa dalam bentuk senyawa anorganik (seperti air dan asam) dan organik air mengandung 11 % massa hidrogen karena molekulnya mengandung 2 atom hidrogen dan 1 oksigen.Hidrogen yang di alam ada 3 isotop, yaitu hidrogen, deuterium, dan tritium Perbandingannya : H:D:T = 10.000.000 : 2.000 : 1## Reaksi-reaksi pada hidrogen
Hidrogenolisis #
Hidrogenolisis adalah suatu reaksi kimia dimana suatu ikatan tunggal karbon- karbon atau karbon–hetero atom mengalami pembelahan atau mengalami lisis (pemecahan) oleh hidrogen. Heteroatom dapat bervariasi, tetapi biasanya adalah oksigen, nitrogen, atau belerang.Contoh reaksi Hidrogenolisis:### 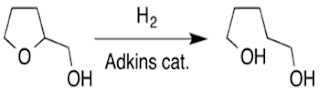
Hidrogenasi adalah suatu reaksi kimia yang melibatkan adisi atau penambahan molekul hidrogen pada suatu molekul. Biasanya reaksi hidrogenasi ini terjadi pada molekul-molekul yang memiliki ikatan rangkap yang tidak jenuh seperti alkena ataupun alkuna. Hidrogen akan teradisi pada ikatan rangkap molekul tersebut sehingga dihasilkan suatu produk yang jenuh.Contoh reaksi hidrogenasi:### 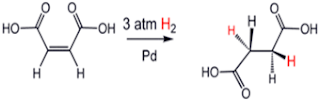
Dehidrogenasi adalah reaksi kimia yang melibatkan penghilangan hidrogen dari molekul organik. Ini adalah kebalikan dari hidrogenasi. Dehidrogenasi merupakan reaksi penting karena mengubah alkana, yang relatif inert dan bernilai rendah, menjadi olefin, yang reaktif dan lebih berharga.Contoh reaksi dehidrogenasi: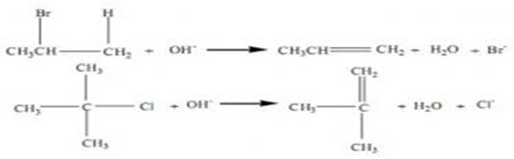
Hidrasi dan Dehidrasi #
Reaksi hidrasi adalah suatu reaksi kimia di mana suatu zat dikombinasikan dengan air. Dalam kimia organik, air ditambahkan pada substrat tak jenuh, biasanya merupakan suatu alkena atau alkuna.Reaksi dehidrasi dalam ilmu kimia biasanya didefinisikan sebagai reaksi yang melibatkan pelepasan air dari molekul yang bereaksi. Reaksi dehidrasi merupakan subset dari reaksi eliminasiContoh reaksi dehidrasi: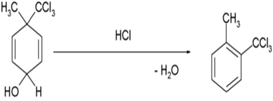
Contoh reaksi hidrasi: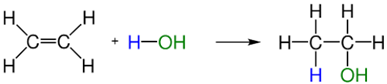
Sifat Fisika dan Sifat Kimia #
Sifat Fisika #
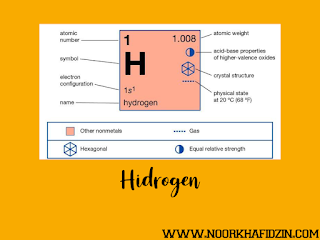
Nomor Atom: 1Massa Atom Relatif: 1Titik leleh: -259, 14°CTitik didih: -252, 87°CWarna: tidak berwarnaKonfigurasi elektron: 1s¹Energi Ionisasi: 1312 kj/molAfinitas Elektron: 72, 77 kj/molKeelektronegatifan: 2, 20 Jari-jari ion: 1, 46 ÅJari-jari atom: 0, 37 ÅMassa Jenis: 0, 0899 g/cm³Struktur Kristal: HeksagonalVolume atom: 14, 10 cm³/molEntalpi penguapan: 0,4581 Kj/molEntalpi pembentukan: 0, 0085 Kj/ molPotensial Ionisasi: 13, 598 VKonduktivitas Panas: 0, 1815 Wm-1Kapasitas Panas: 14, 304 Jg-1 K-1Nama golongan: AlkaliWujud: gasJenis Unsur: nonlogam### Sifat Kimia
Kehilangan elektron valensi 1s. Hal ini akan menghasilkan proton, H+. Ukurannya yang kecil, r ~ 1,5 x 10-13 cm, relatif terhadap ukuran r ~ 10-8 cm serta muatannya yang kecil yang dihasilkan oleh kemampuannya yang khas untuk mendistorsi awan elektron di sekeliling atom-atom lain. Proton tidak pernah dalam bentuk seperti itu kecuali dalam berkas ion gas. Proton ini bergabung dengan atom-atom atau molekul-molekul lain. Meskipun ion hidrogen berada dalam air, umumnya ditulis sebagai H+, tapi sesungguhnya H3O+ atau H(H2O)n+.Penambahan satu elektron. Atom H dapat memperoleh satu elektron dan membentuk ion hidrida, H- dengan struktur He 1s2. Ion ini hanya ada dalam kristal hidrida dari logam-logam elektropositif, seperti NaH, CaH2.Pembentukan sebuah pasangan elektron. Nonlogam dan juga banyak logam dapat membentuk ikatan kovalen dengan hidrogen.## Kegunaan
1. Pembuatan pupukManfaat gas hidrogen dalam ilmu biologi yang pertama yaitu sebagai bahan untuk membantu proses pembuatan beberapa jenis pupuk. Bidang industri yang cukup sering menggunakan hidrogen dalam proses produksinya adalah dalam pembuatan pupuk. Cara kerjanya adalah dengan mereaksikan atau mengombinasikan senyawa hidrogen tersebut dengan senyawa nitrogen, sehingga dapat menghasilkan produk pupuk yang disebut dengan pupuk amonia.2. Mengilangkan kandungan sulfur pada beberapa jenis bahan bakar dari fosilProses penghilangan sulfur menggunakan hidrogen disebut dengan hidrodesulfurisasi. Tujuan dari penggunaan hidrogen ini adalah agar dampak polusi yang dihasilkan dari proses pembakaran dapat terminimalisir. jenis-jenis bahan bakar yang menggunakan hidrogen adalah bensin, solar, avtur, minytak tanah, dan lain-lain.3. Bahan kimia organikManfaat gas hidrogen dalam ilmu biologi yang pertama adalah dapat digunakan sebagai bahan kimia organik. Karena gas hidrogen ini memiliki peranan untuk melakukan suatu reaksi yang disebut dengan reaksi hidrogenasi untuk beberapa jenis senyawa yang bersifat organik. Jenis reaksi lainnya yang dihasilkan oleh gas hidrogen diantaranya adalah reaksi kimia asilasi.4. Sebagai bahan bakarHidrogen dapat digunakan sebagai bahan bakar karena dapat terbakar membentuk air dan menghasilkan energi. kelebihan dari hidrogen sebagai bahan bakar antara lain suatu cuplikan hidrogen jika dibakar akan menghasilkan kira-kira tiga kali energi yang dihasilkan bensin dengan berat yang sama. selain itu menghasilkan sedikit solusi.5. Sintesis amonia****6. Pembuatan asam nitratOksidasi amonia menghasilkan NO, Amonia dihasilkan dari hasil haber.7. Pembuatan margarinMinyak yang merupakan ester tidak jenuh diubah menjadi senyawa yang jenuh.8. Digunakan sebagai cairan krigonik
9. Sintesa Metanol****10. Bahan bakar Roket (karena ringan dan memiliki panas tinggi)11. Reduksi batuan tambang12. H2 Cair digunakan dalam superkonduktor, karena titik lelehnya hampir absulut nol.13. Dua isotop hidrogen yang lebih berat (deuterium dan tritium) digunakan dalam fusi nuklir.